目前,全球诸多科研单位正在为 COVID-19 病毒积极寻找一种有效的疫苗,一旦研制成功,那下一个挑战或将是在世界各地制造和分销它。
来自得州大学奥斯汀分校药剂学教授玛丽亚·克罗伊尔(Maria Croyle)的研究团队开发出了一种新技术,可以将活病毒和生物药物稳定在一种无需冷藏、可以口服的快速溶解薄膜中,不仅能提供与注射一样有效的剂量,而且有效期可达 3 年之久。
这项研究曾针对埃博拉疫苗进行试验,三年前制作的含有病毒的薄膜被保存在实验室的密封容器中。研究人员给它们进行“补水”,并对它们进行测试,以确定疫苗是否仍然能够诱导免疫反应。令人惊讶的是,薄膜中超过 95% 的病毒仍然活跃,对于一种不需冷藏的疫苗来说,达到这种保质期是惊人的。
几乎所有储存的疫苗都会随着时间的推移失去效力,而贮存温度是很大的影响因素之一,保持疫苗持续冷藏是困难和花成本的,尤其是在一些发展中或落后的国家、地区,这些条件可能不具备。
这项新技术论文近日发表在 Science Advances ( Science 子刊)杂志上,未来可能大幅改善全球获得疫苗和其他生物药物的机会,改变疫苗药品在全球的现有流通方式。

▲研究人员制作的快速溶解薄膜(来源:CC BY-ND)
据了解,该研究团队从 2007 年开始研究这项技术,当时美国国立卫生研究院(NIH)提出需求要开发一种无针、稳定的疫苗运送方法。
而利用薄膜封存疫苗的灵感,则来自于一部讲述昆虫和其他生物 DNA 如何在琥珀中保存数百万年的纪录片。不过这只是一个简单的设想,从来没有试验成功过,在疫苗储存过程中要么会破坏形成膜或结晶的有机物,要么将病毒或想要保存的细菌灭活。但最后,研究人员终于发现了一种可以将病毒和细菌悬浮在可剥离薄膜中的配方。
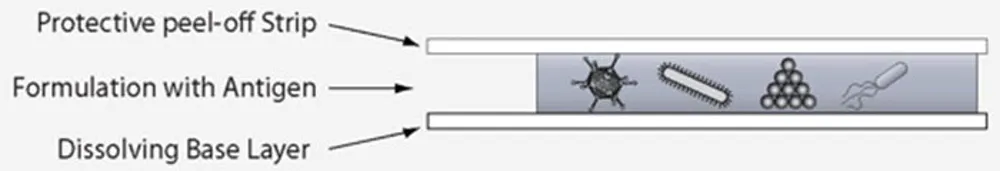
▲诸如麻疹、小儿麻痹症、流行性感冒、乙型肝炎和埃博拉病毒的疫苗,以及用于治疗感染和癌症的许多治疗性抗体,都可以小心地夹在保护层之间。(来源:CC BY-ND)
这项新的薄膜技术,可以在长时间不冷藏的情况下保存活病毒、细菌、抗体和酶。研究结果证明,通过 16 次冻融循环仍可以回收活病毒,而且通过舌下和口腔途径对小白鼠施用活流感病毒可诱导抗体介导的免疫反应,其效果与肌肉注射的效果相同甚至更好。
在最初的试验中,研究人员们筛选了 400 多种制剂,以确定其增强基于腺病毒的埃博拉疫苗的免疫应答能力,然后评估能提供良好体内数据的制剂,以及在薄膜基质中稳定重组腺病毒的能力,进一步的研究表明,有一种制剂可在室温下使腺病毒稳定保存 3 年,该薄膜技术还能够在室温下保存活菌 8 个月,并且在重组后的存活率损失最小。在室温下,嵌入该薄膜中的一级抗体和抗体酶结合物的性能优于在相同条件下存储在制造商液体配方中的相同产品的性能。
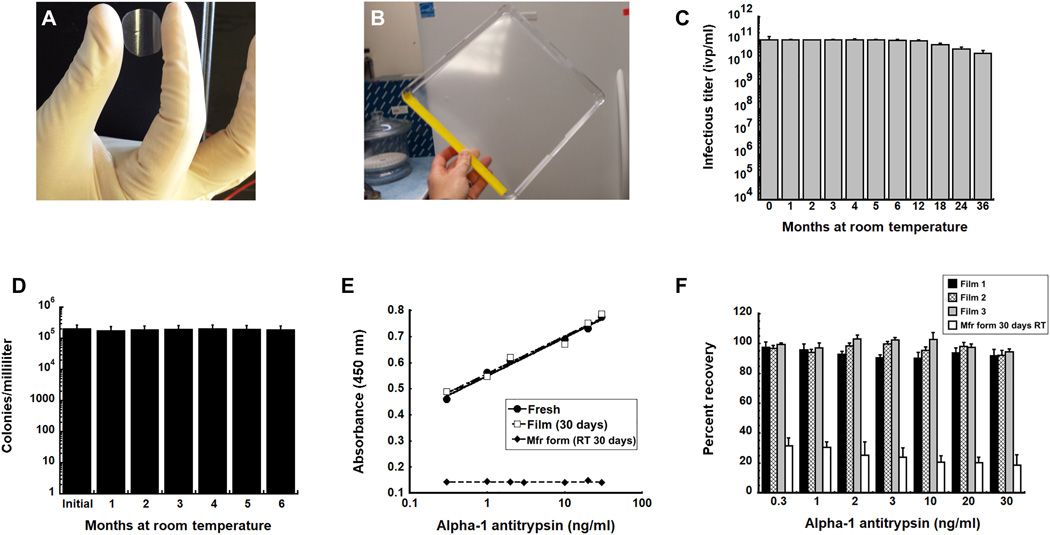
▲薄膜技术在环境温度下长时间稳定活微生物和生物化合物。(来源:Science Advances)
如上图所示,图 C 展示了重组腺病毒在固体膜基质中 36 个月的稳定性情况,复制膜保存在 20°C 下,用无菌水重组,用标准限制稀释试验评估感染滴度;图 D 为含活菌膜在 20℃下的 6 个月稳定性曲线;图 E 展示了一级抗体在薄膜中稳定并在 20°C 室温下保存 30 天的结合亲和力优于制造商产品在相同条件下作为液体保存的结合亲和力;图 F 展示了在 20℃的薄膜中保存后,恢复驴抗鼠 IgG 抗体 AP192P、辣根过氧化物酶(HRP)结合物(Millipore)的结合亲和力。
此外,为了确定在新型薄膜中恢复和保留病毒感染性的关键因素,研究人员根据分项因子设计评估了 30 多种缓冲液和赋形剂的组合,初步研究了溶剂、碱浓度、粘合剂和表面活性剂的存在以及最终配方的 pH 值对感染性病毒的恢复影响。
具体而言,确定稳定性的关键配方成分包括溶剂,赋形剂选择和 pH。在没有缓冲剂的情况下,用最低量的碱性赋形剂生产的薄膜不能恢复感染性病毒,使用磷酸盐缓冲盐(PBS)制备含有最低浓度碱基的薄膜可显著提高感染性病毒颗粒(ivp)的回收率(73%),用低和中等碱浓度的 tris 缓冲液制备的制剂显示活病毒的回收率大于 95%。干燥后能够恢复 90%以上原始病毒滴度的薄膜制剂的最终 pH 值在 6.5 至 7.4 范围内。
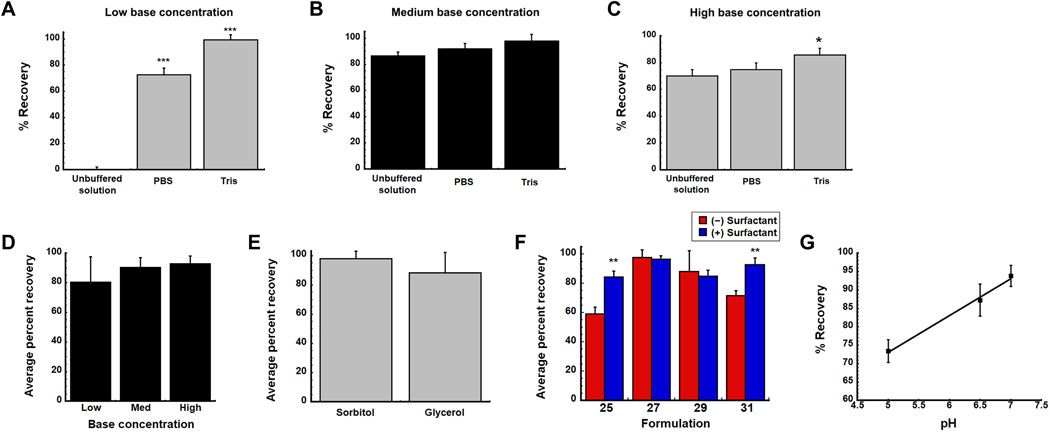
▲保持病毒从膜基质中恢复的溶剂和赋形剂组合在干燥过程中保持最佳 pH(来源:Science Advances)
另外,表面活性剂对病毒从薄膜中释放的速率起作用。单独用基本赋形剂制备的薄膜在置于 37°C 的 PBS 中并缓慢搅动后,以每分钟 6.3×10^6 ivp / ml 的速度释放病毒,添加山梨糖醇可使该速率增加了两倍,当制剂中同时还包含表面活性剂时,速率可增加 10 倍,达到每分钟 6.0×10^7 ivp / ml。
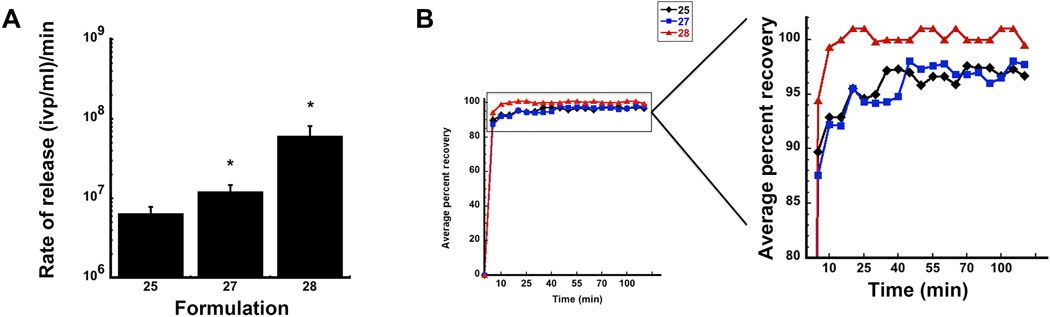
▲从膜基质释放病毒是可调的,图 A 通过逐步添加赋形剂制备的膜的病毒释放速率,图 B 包含碱,粘合剂和表面活性剂组合的薄膜的累积释放曲线,25、27、28 代表不同配方代号。(来源:Science Advances)
试验结果显示,仅使用基本赋形剂(配方 25)制备的薄膜在 5 分钟内释放了 90%的剂量,2 小时后仅释放了总剂量的 97%。加入山梨糖醇(配方 27)导致 5 分钟后释放 88%的剂量,但 2 小时后仅略微改善释放至全剂量的 98%。添加含有表面活性剂和山梨糖醇的薄膜(配方 28)可在 5 分钟内把全部感染病毒释放出来。
关于膜的机械性能,团队在筛选过程中也评估了每种薄膜配方的效果,因为薄膜的延展性不仅决定了生产的可行性,还决定了其易于操作和操纵的程度,经过评估,山梨糖醇被选为最理想的粘合剂。
研究人员也对薄膜的疫苗效力进行了体内评估。将包含稳定的 H1N1 流感病毒薄膜基质施用于 BALB/c 小鼠的 BU 和 SL 粘膜,薄膜放入口腔后 30 到 60 秒内溶解。同时,通过肌肉注射途径分别给予同等剂量的病毒给小鼠进行对比试验,免疫后 28 天收集的血清分析表明,所有治疗组的抗流感免疫球蛋白 G(IgG)抗体水平与具有确定的保护性中和抗体滴度的对照抗体之间均无显着差异。
与通过肌肉注射的动物相比,通过 BU 黏膜途径免疫的动物具有更高的中和抗体水平,且薄膜制剂具有良好的耐受性,并且在给药和溶解膜后对 BU 或 SL 粘膜无可见刺激,证明了口服免疫策略的可行性。
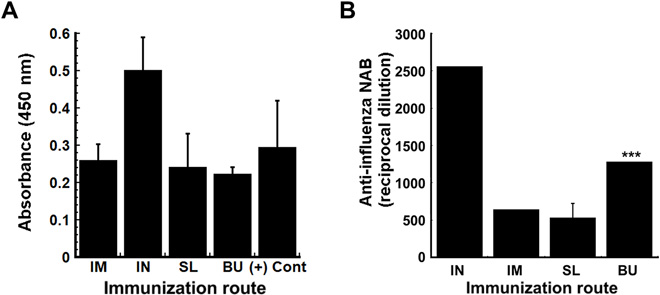
▲A 指不同免疫途径给予的病毒剂量,B 指产生的抗体免疫强度,IM,肌内;IN,鼻内;SL,舌下;BU,颊部。(来源:Science Advances)
这种新型的薄膜技术可以用更小的空间容纳单剂量的疫苗,团队粗略计算,把 35 万剂卡介苗加入到这样的薄膜产品中时,大概就是 600 张 8.5×11 英寸的床单,重量仅约 3 公斤,而如果用目前的存储和包装(小瓶和安瓿稀释液等)来分装相同剂量的疫苗数量,则需要一个美式足球场(5749 平方米)的空间来储存,且重量高达 2730 公斤。

▲该技术可以节省空间的形式稳定保存疫苗,使其更易于在全球范围内运输和分发。(来源:CC BY-ND)
举个最典型的例子,2004 年菲律宾消除麻疹计划在一个月内为 1800 万儿童进行了免疫接种,共生产了 1950 万个注射器,接种计划完成后则意味着留下 143 吨尖锐废物和将近 80 吨医疗垃圾(空瓶、注射器包装纸、瓶盖、棉签和包装等),目前市场上的大多数流感疫苗都是通过注射给药的,基于薄膜基质稳定的疫苗可以通过无针方式自行口服避免医疗垃圾的产生。
此外,据约翰·霍普金斯大学彭博公共卫生学院的一项调研显示,在 2011-2020 年的 10 年内,在 94 个国家/地区实施的 18 种疫苗接种计划总共花费了约 640 亿美元,其中一半以上的成本来自于服务交付,金额达 340 亿美元,另外还有 40 亿美元的供应链成本,而新的薄膜技术有望大幅降低当下疫苗和其他生物药品的存储、分发、管理等相关成本。
编辑:王星
责任编辑:姜澎
来源:DeepTech深科技
声明:转载此文是出于传递更多信息之目的。若有来源标注错误或侵犯了您的合法权益,请作者持权属证明与本网联系,我们将及时更正、删除,谢谢。





