2021年8月20日,中国科学院上海药物研究所蒋轶/徐华强团队联合谢欣团队,在《自然-通讯》上发表了一项研究成果,首次报道了饥饿素受体(ghrelin receptor)分别结合内源多肽激素——饥饿素(ghrelin)和促生长激素释放肽-6(GHRP-6),以及Gq蛋白信号复合体的近原子分辨率结构,揭示了饥饿素受体独特的配体识别和激活的分子机制。

食物摄取是维持人类生命最基本的活动之一,该过程主要由两类内源性激素——瘦素和饥饿素共同调控。这两类激素分别发挥抑制和促进食欲的作用,两者的平衡共同调控机体的能量稳态。
饥饿素是目前唯一已知由胃组织分泌的促食欲激素。它通过血液循环作用于脑垂体中的饥饿素受体,感知饥饿进而发挥促食欲作用。
同时,饥饿素也是目前唯一被发现在生理状态下被脂肪酸修饰的内源多肽激素,其第三位丝氨酸可经酰基转移酶催化发生辛酰化修饰,该修饰对饥饿素识别和激活饥饿素受体至关重要。
由于饥饿素系统重要的生理功能,饥饿素受体也成为当前治疗肥胖症等代谢性疾病的热门靶标之一。
然而,由于饥饿素与其受体复合物等关键结构的缺失,有关饥饿素识别饥饿素受体的模式、辛酰化修饰在饥饿素识别受体中的机制,以及饥饿素受体激活机制等关键科学问题尚未解决,这也为理解饥饿素的作用机制,以及开发靶向饥饿素受体的药物带来了巨大挑战。
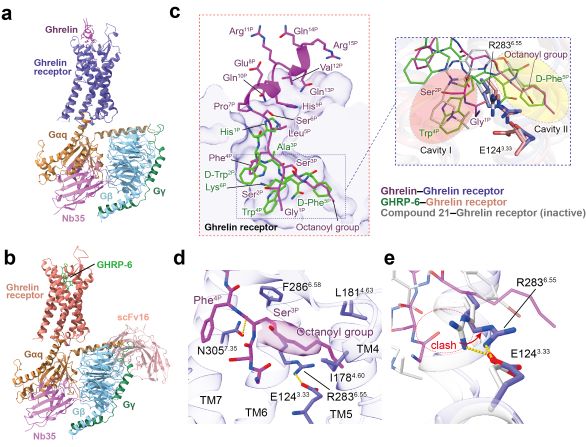
▲Ghrelin受体分别与Ghrelin和GHRP-6复合物的冷冻电镜结构。a. Ghrelin-ghrelin receptor-Gq复合物的结构;b. Ghrelin-ghrelin receptor-Gq复合物的结构;c. Ghrelin和GHRP-6与ghrelin受体的结合模式图。d. Ghrelin的辛酰化修饰基团与受体口袋残基的相互作用图;e. Ghrelin受体的激活机制。
本研究中,团队成员利用冷冻电镜的手段解析了饥饿素受体分别结合饥饿素和GHRP-6,以及下游Gq蛋白两个复合物的结构,分辨率分别为2.9和3.2埃(上图a, b)。
结合配体结合和细胞功能分析,该研究揭示了饥饿素和GHRP-6与饥饿素受体结合口袋的精确结合模式(上图c);证实了由受体残基I178、L181和F286组成的疏水网络在饥饿素辛酰化基团识别中的关键作用,提出了由辛酰化基团促进饥饿素在口袋的正确定位,并结合和激活受体的作用模型(上图d)。
同时,科研人员阐明了E124和R283间保守的盐桥对稳定受体的关键作用,解释了激活多肽诱导R283向受体螺旋核心摆动,进而激活饥饿素受体的新机制(图1e)。
该工作为理解饥饿素受体的配体识别和激活机制提供了精准的结构模型,也为靶向饥饿素受体的药物设计提供了新机遇。
本研究中的冷冻电镜数据在上海药物所冷冻电镜平台收集。上海药物所2018级博士生王悦、南京中医药大学与上海药物研究所联合培养博士生郭世猛、上海药物所研究助理庄友文、徐沛雨以及上海药物所博士生贠盈为该论文的共同第一作者。蒋轶研究员、谢欣研究员,以及徐华强研究员为共同通讯作者。上海药物所为本研究的第一完成单位。
作者:许琦敏
责任编辑:任荃
图片来源:中科院药物所
*文汇独家稿件,转载请注明出处。





