
新冠肺炎病毒因其强大的感染和传播能力,在全球掀起了一场紧急防控大战。在这一过程中,一系列疑问在医生、科学家,甚至普通人的心中浮现:是什么决定了冠状病毒是否、何时、如何传染给人类,以及达到怎样的传染程度?为什么不同冠状病毒的致病性会有如此大的区别:有的只是让人流鼻涕,而有的则会引发重症肺炎?过去十几年,科学家一直在对冠状病毒进行分子生物学研究,并试图回答这些问题。
拥有RNA病毒中最长基因组
冠状病毒基因组由三万个碱基组成,是RNA病毒中最长的。病原体复制的材料越多,出错的几率就越高,这些突变可能赋予病毒感染新物种的能力

大多数人第一次听说“冠状病毒”是在2003年。不过,人们可能已经遭遇过它们中较温和的一些种类——有四种冠状病毒毒株导致了约五分之一的普通感冒,其他类型毒株则引发了某些动物种群特有的流行性疾病。一直到约20年前,所有已知的冠状病毒感染人类变种所引起的疾病都非常轻微,以至于医学界、科研界对冠状病毒的研究进展相当缓慢。
2003年SARS暴发。当其病原体被确认为冠状病毒时,“与该领域相关的每个人都为之震惊,人们开始真正关心这类病毒。”美国宾夕法尼亚大学的微生物学家苏珊·维斯说。
目前普遍认为,SARS是由于一种冠状病毒从动物(很可能是经由果子狸)传染给了人类。2012年,另一种冠状病毒则可能经由骆驼传染给人类,引发了中东呼吸综合征(MERS)。这些新发传染病的流行,使得冠状病毒日益受到人们重视。
据已有研究推测,SARS病毒、MERS病毒和新型冠状病毒,很可能都起源于蝙蝠。对新冠病毒基因组的最新分析发现,它与一种以前从蝙蝠中鉴定出的某种冠状病毒的RNA有96%的相似度。美国爱荷华大学的微生物学家斯坦利·佩尔曼说:“这些病毒在蝙蝠体内漂浮了很长时间”,但并没有使蝙蝠生病,这表明病毒从蝙蝠感染到人,可能还涉及一个或几个中间宿主物种。这种情况似乎是冠状病毒引发疫情的一个常见特征——通过某些中间宿主,可能触发了病毒更多的突变,从而增加了病毒的遗传多样性。
这些突变是如何发生的?冠状病毒是有包膜的单链RNA病毒,这意味着它们的基因组由一条RNA链组成,每个病毒颗粒都包裹在一个蛋白质“包膜”中。
基本上,病毒做的事情都很雷同:侵入一个细胞,利用其中一些成分复制出大量病毒自身的拷贝。在细胞崩解后,这些复制出来的病毒再去感染其他细胞。但RNA复制通常缺乏细胞复制DNA时使用的纠错机制,因此RNA病毒在复制过程中出错概率更高。
冠状病毒是所有RNA病毒中基因组最长的,由三万个碱基组成。病原体复制的材料越多,出错的几率就越高。这所导致的结果就是,这些冠状病毒突变得非常快。在这些突变中,有的可能就赋予了病毒感染新细胞类型、甚至新物种的能力。
冠状病毒颗粒由四种结构蛋白质组成:核衣壳、包膜、膜和刺突。核衣壳形成遗传核心,包裹在一个由包膜和膜蛋白形成的球体中。刺突蛋白质形成棒状突起,突出分布在整个球形外表上,类似于王冠或太阳的日冕——这也是冠状病毒名称的由来。这些突起与宿主细胞上的受体结合,决定了病毒可以感染的细胞类型,从而也决定了病毒感染物种的范围。
感染哪些细胞还要看“助攻”
冠状病毒成功入侵细胞,所依靠的不只是一种受体,其他辅助受体也可能参与其中。同时,它还有个十分重要的“帮凶”,那就是它们的“辅助”蛋白质
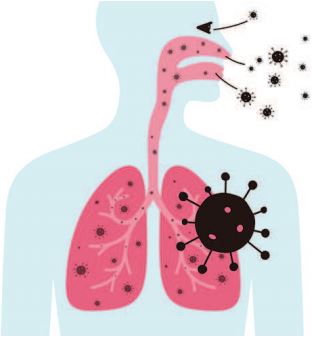
有的冠状病毒只引起普通感冒,而有的则会引起严重疾病。据研究,它们之间的主要区别是,前者主要感染上呼吸道(鼻子和喉咙),而后者则在下呼吸道(肺)大量繁殖,并可导致肺炎。例如,SARS病毒会与一种名为ACE2的受体结合,而MERS病毒则与一种名为DPP4的受体结合,这两种受体都存在于肺细胞中。
这些受体在组织和器官中的分布差异,可能是不同类型冠状病毒所导致的疾病症状各不相同的原因。例如,人们已经发现MERS比SARS更致命,而且有更明显的胃肠道症状,但MERS病毒的感染性并不强,这也可能是一种与受体相关的特性。
英国爱丁堡大学的病毒学家克里斯汀·泰特·伯卡尔德认为,DPP4在下支气管(通向肺部的气道)中高度表达,所以必然需要有大量病毒进入其中才能引发疾病。由于我们的气道非常善于过滤病原体,因此人类需要长时间、高强度地暴露于病毒环境中,MERS病毒才能到达肺部,这就是为什么与其中间宿主(很可能是骆驼)密切接触的人才会生病的原因。
相反,由于病原体更容易进出上呼吸道,所以在那里繁殖的病毒感染性更强。此外,“病毒在不同温度下复制的能力有很大不同,因为上呼吸道更冷一些。”泰特·伯卡尔德说,“如果病毒在这些温度下更稳定,它就不会进入下呼吸道。”她补充说,下呼吸道也是一个生化和免疫上更恶劣的环境。
对新冠病毒的分析非常清晰地表明,与SARS一样,这种新病毒利用ACE2受体获得进入细胞的入口。这种观察与这样的事实相吻合,即到目前为止,该病毒的致死率似乎低于MERS。
然而,情况并不那么简单,因为使用相同受体的病毒也可能导致截然不同的疾病。一种名为NL63的人类冠状病毒与SARS病毒结合在同一受体上,但只会导致上呼吸道感染,而SARS病毒则主要感染下呼吸道。为什么会这样?目前科学家还不清楚其中的原因。
此外,另一个令人好奇的现象是,ACE2受体普遍存在于心脏,但SARS不会感染心脏细胞。南非西开普大学的分子生物学家伯特兰姆·菲尔丁认为,就病毒进入细胞的效率而言,不仅只有一种主要的受体,可能还有其他辅助受体参与其中。
研究还发现,冠状病毒有一位十分重要的 “帮凶”,那就是它们的“辅助”蛋白质。病毒与受体结合只是进入细胞的第一步,当病毒与宿主细胞结合时,它们开始一起变形,而且其他病毒蛋白可能与其他受体结合,最终完成侵入细胞的过程。
可关闭免疫应答的各个环节
冠状病毒所导致的很多疾病属于一种破坏性的免疫反应,又称炎症反应。这也将决定一种病毒的毒性有多大,即它会诱导多大程度的破坏性免疫应答
研究发现,冠状病毒的“辅助”蛋白似乎参与了逃避宿主的先天免疫应答,那可是身体防御机制的前线。先天免疫应答会在细胞检测到入侵者、释放干扰病原体复制的干扰素时启动。干扰素会触发免疫系统抗病毒的级联反应,从停止宿主蛋白合成,一直到诱导细胞死亡。
不幸的是,这些进程中的大多数步骤对宿主也不太有利。“实际上,冠状病毒所导致的很多疾病属于一种破坏性的免疫反应,又称炎症反应。”苏珊·维斯说,这也将决定一种病毒的毒性有多大,即它会诱导多大程度的破坏性免疫应答,而不仅仅只是保护性应答。
这也可以用来部分解释,为什么新冠病毒会使一些轻症患者突然转向重症、危重症。迄今为止,有相当部分死于新冠病毒的病例都患有合并症,比如自身免疫性疾病或继发性感染。“一旦我们的先天免疫系统忙于与病毒作战,这种合并症就会变得更加普遍。”泰特·伯卡尔德说,这就是为什么临床上更重视治疗患者的合并症,并给他们服用抗生素来阻止细菌感染。
当然,免疫应答的目的在于消灭入侵者,而病毒对此也有应对手段,而且各种冠状病毒的应对手段各不相同。“这些病毒关系密切,但它们有不同的辅助蛋白,”苏珊·维斯说,它们已经进化到能够关闭先天免疫应答的各个环节。
一些研究人员则认为,蝙蝠之所以携带冠状病毒,是因为它们不会积累像人类那样强烈的免疫应答。泰特·伯卡尔德说:“蝙蝠体内有大量信号转导分子,这些分子在人体内会提醒免疫系统产生免疫反应,它们在蝙蝠体内却受到了抑制,从而减弱了免疫反应。”蝙蝠体内对病毒保持一种持续的低水平免疫应答,这既让蝙蝠不易生病,又可能有助于病毒的进化,“蝙蝠是很好的选择压力容器,在这样的环境中,那些擅长逃避免疫应答、善于隐藏的病毒更容易得到选择与进化”。
然而,这些“帮凶”蛋白还远没有被完全了解。“它们可以从一些病毒中去除,而不会影响病毒的生长能力。”斯坦利·佩尔曼说,一般认为,如果有一种蛋白质是病毒对抗免疫应答的关键所在,那么如果把这种蛋白从病毒中去除,人体免疫应答就能有效工作了——但事实未必如此。
一些研究人员认为,辅助蛋白会影响冠状病毒的致病性。有研究表明,去除SARS病毒的一种辅助蛋白并没有改变病毒的复制效率,但其致病性却降低了。
为何冠状病毒会具有如此多样的辅助蛋白?泰特·伯卡尔德说,与其他病毒相比,冠状病毒确实具有纠正基因错误的能力,但它忽略了其基因组的某些区域,因此有两个区域特别容易发生突变:编码刺突蛋白和辅助蛋白区域。
“在这两个区域,冠状病毒允许在复制中大量出错,而这恰恰推动了它们的进化,因为这使得病毒可能与新的受体结合、逃避新生物系统的免疫应答。”他说,这同样也解释了为什么冠状病毒很擅长从一个物种跳到另一个物种。
作者:李升伟编译
编辑:沈湫莎
责任编辑:许琦敏
*文汇独家稿件,转载请注明出处。





