
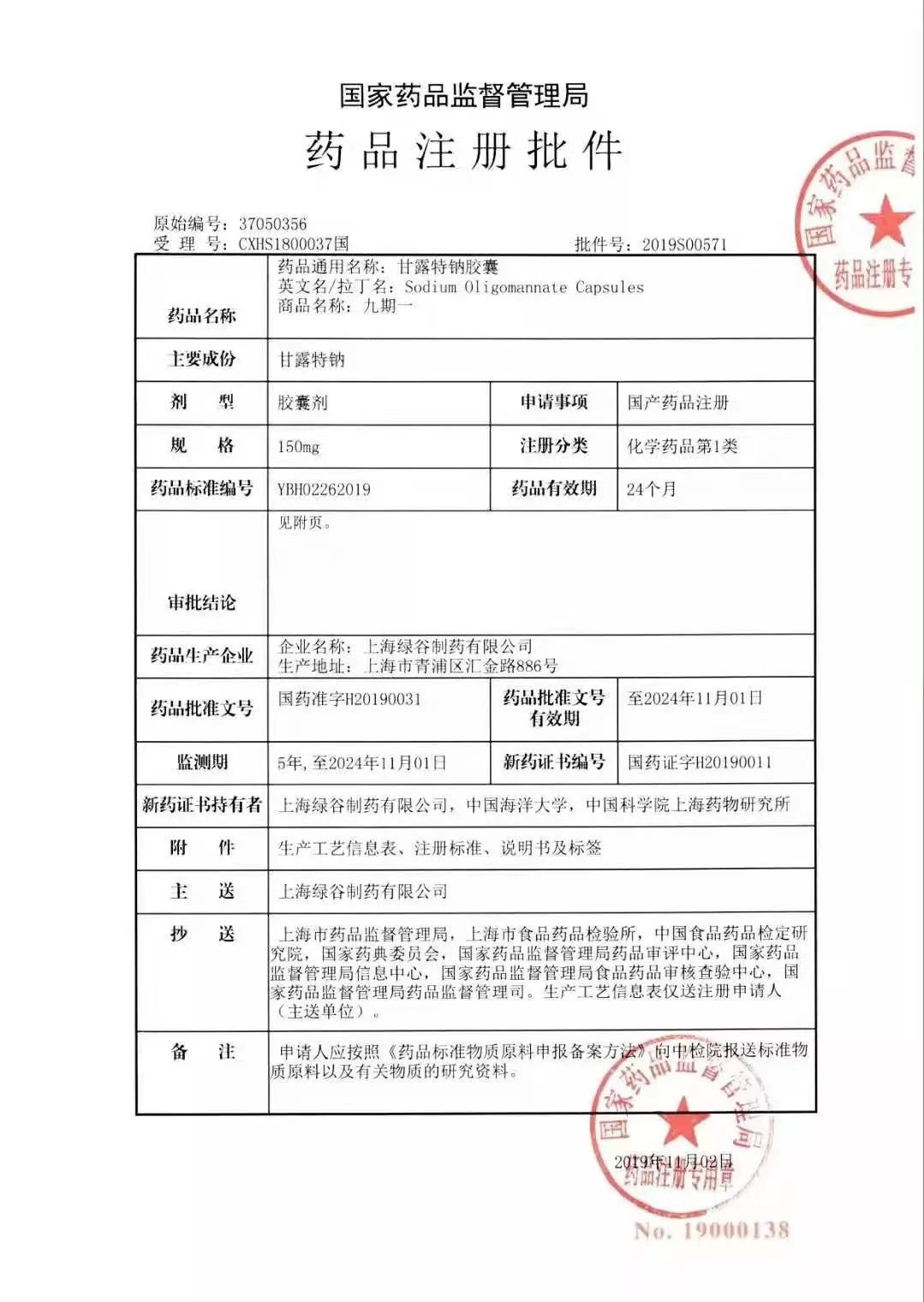
我国原创治疗阿尔茨海默病新药九期一(甘露特钠胶囊,代号:GV-971),终于从一纸新药证书变成了造福患者和患者家庭的一粒新药。
在今天由中国科学院上海药物研究所主办的九期一全球战略发布暨第一届脑肠轴论坛上,九期一中国3期临床主要牵头研究者、上海交通大学医学院附属精神卫生中心教授肖世富,九期一中国3期临床主要牵头研究者、北京协和医院神经医学科教授张振馨,首次系统公开解读了九期一临床研究数据与结果。
九期一临床数据解读
九期一进入临床试验以来,先后有1199例中国受试者分别参加了1、2、3期临床试验研究。其中3期临床试验由北京协和医院和上海交通大学医学院附属精神卫生中心牵头组织的全国34家三级甲等医院开展,共完成了818例受试者的服药观察。这也是阿尔茨海默病药物领域全球首个长达9个月的纯安慰剂对照研究。
临床试验结果显示,九期一有效率为78%,可以持续、明显改善患者的认知功能,且安全性好,不良事件发生率与安慰剂组相当。
投入30亿美元开展全球研究
与九期一在中国上市同步,上海绿谷制药有限公司今天宣布,未来拟投入30亿美元,支持九期一上市后真实世界研究、国际多中心3期临床研究“绿色记忆”、扩大适应症研究和机制深入研究等。
其中国际多中心3期临床研究,将以超过2000例轻、中度阿尔茨海默病患者为对象,在北美、欧盟、东欧、亚太等地区的200个临床中心开展12个月的双盲试验和6个月的开放试验,进一步深入验证九期一的临床价值。
据悉,九期一国际多中心3期临床研究由美国阿尔茨海默病协会终身成就奖(2018)获得者、美国克利夫兰医学中心卢鲁沃脑健康中心主任教授杰弗里·卡明斯(Jeffrey Cummings)领衔主导并担任首席科学家,他同时也是绿谷制药有限公司的科学决策委员会主席。
绿谷透露,计划2024年完成国际多中心临床试验,争取在2025年完成新药全球注册申报。公司表示,将以开放、平等、共享、全球运作的规则设立开放性专项研究基金,支持全球优秀科学家共同参与“九期一”及其机理深入研究,以推动脑肠轴与大脑疾病共性机制的深度研究。
负责九期一中国3期临床试验的全球最大医药临床试验业务公司艾昆纬与绿谷签约,继续负责九期一国际多中心3期临床试验管理。
阿尔茨海默病是发生于老年和老年前期、以进行性认知功能障碍和行为损害为特征的中枢神经系统退行性病变,临床上表现为记忆障碍、失语、失用、失认、视空间能力损害、抽象思维和计算力损害、人格和行为改变等。

九期一是以海洋褐藻提取物为原料,制备获得的低分子酸性寡糖化合物。临床前作用机制表明,九期一是通过重塑肠道菌群平衡,抑制肠道菌群特定代谢产物的异常增多,减少外周及中枢炎症,降低β-淀粉样蛋白沉积和Tau蛋白过度磷酸化,从而改善认知功能障碍。
在我国,目前约有1000万阿尔茨海默病患者,预计到2050年患病人数将超过4000万,比加拿大的总人口还要多。自发现阿尔茨海默病100多年来,全球用于临床治疗的药物只有5款。
中华医学会副会长、中国工程院院士杨宝峰在今天的战略发布会上指出,阿尔兹海默病目前还是世界医学的难题,中国能在这个领域占有一席之地,而且是在全世界17年来无新药获批的背景下取得的原创性的成果,这非常难能可贵。
国家卫生健康委员会、科学技术部、中国科学院有关负责人,中华医学会、中国药学会、中国药促会、中国药理学会等学会负责人、国内外神经医学领域知名专家等共600余人出席发布会。
作者:许琦敏
编辑:沈湫莎
责任编辑:任荃
*文汇独家稿件,转载请注明出处。





