肿瘤侵袭前沿区的细胞互作及促侵袭、转移机制
恶性实体瘤是一个复杂的生态系统,不同组织区域具有高度的空间异质性。肿瘤交界区域是肿瘤侵犯癌旁组织以及肿瘤细胞与癌旁的其他细胞群体直接接触的区域,也是肿瘤细胞向外侵润和转移的最活跃区域。目前对肿瘤的交界区域细胞成分、交互作用和功能特点仍不明确,全面揭示实体瘤不同区域尤其是肿瘤交界区域的细胞组成、空间异质性和细胞间交互作用对于解析肿瘤侵袭转移机制和研发肿瘤治疗新策略至关重要。

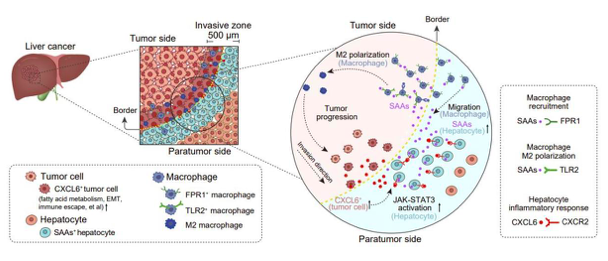
近日,在樊嘉院士指导下,复旦大学附属中山医院周俭教授团队与华大研究院合作,在《细胞研究》(Cell Research,影响因子46.3)杂志在线发表研究论文,精准谱绘了肝癌空间异质性,重点聚焦肿瘤交界区,首次发现横跨肝癌和癌旁组织交界线上两侧各250µm的特殊带状区域,将该区域定义为肿瘤侵犯前沿区(Invasive zone)。该研究可为探索恶性实体瘤的侵袭转移机制,研发肿瘤治疗新策略提供新的角度和依据。
研究者利用华大自主研发的纳米级别分辨率的空间转录组技术(Stereo-seq),结合华大自主开发的单细胞转录组技术“DNBelab C4”,详细谱绘了原发性肝癌不同组织(肿瘤组织、交界组织、癌旁组织和淋巴结)的单细胞和空间转录图谱,发现不同组织区域的细胞组成和转录组水平存在差异,尤其肿瘤交界区变化最明显,提示交界组织区域是一个具有低氧微环境、加剧的炎症反应和局部免疫抑制特征的区域。
为进一步精准解析交界组织附近的空间异质性,团队构建了一种新的空间扫描和数字化模型(SDM)方法,以交界线为参考线将两侧的组织区域划分成约25*25µm²为单位的不同区带。通过解析空间转录组数据发现肿瘤交界线两边各250µm的特殊区域,表现为明显富集免疫细胞尤其是巨噬细胞,同时具有高度的免疫抑制微环境、肿瘤细胞脂肪酸代谢增强和上皮间质转换(EMT)、肝细胞处于严重损害状态等特征,因而将该特殊区域定义为肿瘤侵袭前沿区。
进一步分析得到的空间转录组数据显示,紧邻肿瘤细胞的癌旁侧肝细胞可能受肿瘤细胞直接侵犯而表现为明显的炎症反应特征,高表达血清淀粉样蛋白(SAAs)等急性时相反应蛋白,这也通过空间多色荧光染色进行了验证。
随后,基于单细胞转录组数据分析表明肝细胞的JAK-STAT3通路的激活介导了肝细胞SAAs的高表达。在此基础上分析交界区肿瘤细胞的空间转录组数据,发现其一个肿瘤细胞亚群(CXCL6阳性亚群)具有侵袭性更强的肿瘤细胞特征,广泛分布在SAAs高表达的肝细胞富集区域。
细胞体外功能实验也证实了肿瘤细胞可通过高分泌CXCL6激活肝细胞JAK-STAT3通路进而促进其SAAs高表达。利用单细胞转录组数据进行细胞间通讯分析表明,肝细胞与巨噬细胞之间存在密切细胞间通讯,可通过包括SAAs-FPR1和SAAs-TLR2等方式发生交互作用。通过进一步的细胞功能实验和空间多色荧光染色,证实肝细胞可通过高分泌SAAs-FPR1来招募巨噬细胞,SAAs-TLR2进一步促进巨噬细胞M2极化,形成局部免疫抑制微环境,促进肿瘤侵袭转移。
研究者利用小鼠原位肝癌和肠癌肝转移模型,通过腺相关病毒敲减小鼠肝脏中SAAs,发现抑制SAAs表达,可明显抑制肿瘤侵袭前沿区巨噬细胞的募集及其M2极化,进而抑制肿瘤的进展。
该项研究首次提出肿瘤侵袭前沿区的概念,并且精准解析和验证侵袭前沿区中局部空间微生态,为临床和病理学重新认识肿瘤侵犯前沿区、探索恶性实体瘤的侵袭转移机制以及研发肿瘤治疗新策略提供新的角度和依据。
复旦大学附属中山医院周俭教授、杨欣荣教授,华大研究院陈奥研究员、刘石平研究员为该研究的共同通讯作者。华大研究院吴靓副研究员、白寅琪博士、邹轩轩博士、许江山博士和复旦大学附属中山医院闫加艳博士、陈霏雨博士、黄傲主治医师为该研究的共同第一作者。该项研究获得国家重点研发计划、国家自然科学基金重点项目、国家自然科学基金原创探索计划和上海市市级科技重大专项、广东省基础与应用基础研究基金等多项基金的资助。
作者:唐闻佳
编辑:顾军
责任编辑:姜澎
图:受访方提供
*文汇独家稿件,转载请注明出处。





