脂质体药物用于肿瘤临床已有20多年,然而临床抗肿瘤疗效并不理想,延长患者总生存期和减少毒性的作用有限,其中重要原因就是在脂质体系统到达肿瘤部位前,装载的药物在循环系统中发生泄漏,导致肿瘤部位的药物暴露量减少,也增加了对健康器官的损害。上海交通大学医学院最新研究成果有望打破这个尴尬。
5月20日,上海交通大学医学院方超教授团队与美国纽约州立大学布法罗分校Jonathan F. Lovell(乔纳森•拉弗尔)教授联合在国际期刊《纳米快报》(Nano Letters)在线发表论文——《纳米碗支撑的脂质体增强药物装载和递送》。该研究首次建立了纳米碗支撑的脂质体系统,可以用于增强药物装载和递送效果。

临床上,许多处方因素会影响脂质体的稳定性,比如磷脂类型和组成比、药脂比、胆固醇含量等。考虑到脂质体药物的“泄漏”可能,已有的应对方法大多是修饰脂质体表面,但这可能同时引入不利的纳米-生物界面相互作用,因此有必要开发一种新的保持脂质体表面特性不变的稳定化方法。
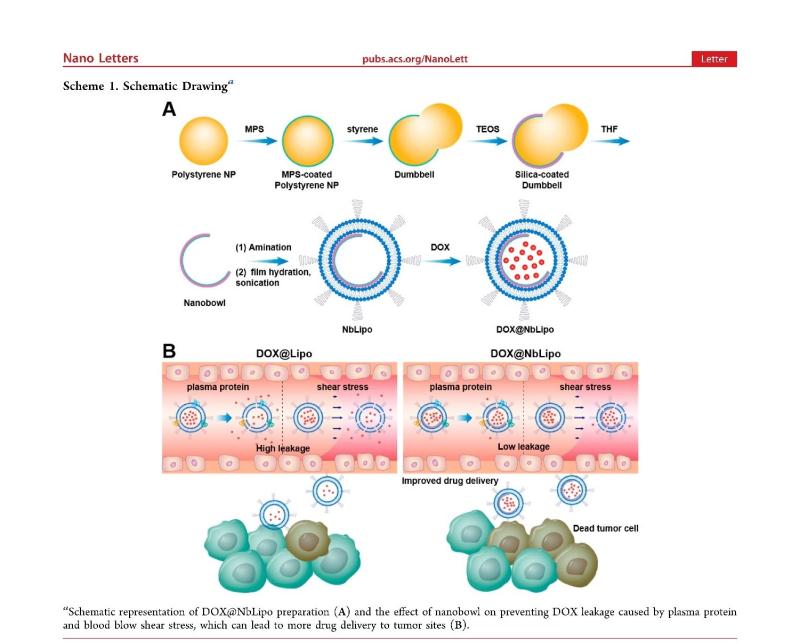
纳米碗是人工构建的纳米尺度的碗状结构。此次研究中,团队人员创新性地将“纳米碗”嵌入脂质体内水腔,创建了一种纳米碗支撑的脂质体,该系统可显著增强药物的装载,并有效抵抗血清蛋白和血流剪切力导致的药物泄露。
其主要原理和机制为——
首先纳米碗开口角为90度至110度,开口面积占内水腔表面积的14.6%至21.3%,与普通脂质体相比,减少了药物从内水腔中泄漏的面积;
其次纳米碗为刚性结构,其对脂质体双分子层的支撑作用可抵抗血清或血流剪切力对膜结构的破坏;
此外,刚性纳米碗可以抵抗硫酸阿霉素晶体对脂质体双层的破坏,并在高药脂比时仍获得高效装载。
动物实验研究结果表明,采用纳米碗支撑的脂质体药物摄取进入肿瘤细胞后,仍可获得快速、高效释放。与普通阿霉素脂质体相比,具有更长的血浆半衰期,可将更多的药物递送至4T1原位乳腺肿瘤部位,显著抑制肿瘤生长和肺转移,与未处理组(生理盐水组)相比,治疗组中位生存期(50天)延长率达108.3%。
与修饰或工程化脂质体表面或双层的现有脂质体稳定化方法不同,本研究仅将刚性纳米碗嵌入现有脂质体制剂的水腔中,这种简单、有效的脂质体稳定策略有望推广应用,并进一步实现临床转化,相关技术已申请中国发明专利。
该研究获得学界广泛关注,论文发表当日就被美国化学会进行了新闻报道,并被10余家国际新闻媒体转载报道。
上海交大医学院研究生陈中坚、杨思聪为论文的共同第一作者,上海交大医学院方超教授和美国纽约州立大学布法罗分校Jonathan F. Lovell(乔纳森•拉弗尔)教授为该论文的通讯作者。上海中医药大学陈红专教授和加拿大多伦多大学郑岗(Gang Zheng)教授也给予了支持帮助。该研究获得国家自然科学基金委、上海市科委和教委项目的资助。
作者:唐闻佳
编辑:顾军
责任编辑:樊丽萍
*文汇独家稿件,转载请注明出处。受访者供图





