北京时间10月9日晚,国际知名学术期刊《自然-方法》(影响因子47.99)刊发了由复旦大学马剑鹏教授领衔的科研团队开发的新型计算方法OPUS-DSD。该算法不但能够成功地解析冷冻电子显微镜(Cryo-EM)结构解析技术中因传统方法无法分辨而缺损的生物大分子(比如蛋白质、核酸或蛋白质/核酸复合物等)结构,并且高效精准地分辨出柔性结构域在受测样品中的构象分布。
这一新方法能有效建立高精度的生物大分子结构模型,帮助解决药物设计中因目标蛋白结构不准而导致的新药研发失败问题。

诺贝尔化学奖得主、复旦大学复杂体系多尺度研究院荣誉院长迈克尔·莱维特表示:“在结构生物学领域,解析生物大分子的柔性结构是一个长期目标。复旦团队开发的新算法使科研人员能通过冷冻电子显微镜看到关键的结构细节,这是以往技术无法实现的,将对生物学、化学研究和药物发现产生重要影响。”
生物大分子结构解析是基础生物科学的关键技术之一,冷冻电镜是其中非常重要的一种研究手段。目前,中国具有世界上最大的冷冻电镜设备集群,然而大部分数据处理所需的软件仍依赖进口。要确立高精度结构模型,就必须发展自主、先进的冷冻电镜数据处理智能算法,从而为我国生命科学研究揭示分子生物学底层机理、重大疾病原理以及进行创新药物研发打下坚实基础。
研究人员罗镇威介绍,生物大分子的许多重要功能是通过其高度的柔性特质来完成的,但柔性也是负面影响结构测定精度的主要因素。在处理冷冻电镜数据的过程中,生物大分子结构柔性引起的构象多样性使得从单个样本中获取精确的三维模型充满挑战。同时,由于冷冻电镜实验数据的信噪比通常极低,为深度学习算法的在该领域的运用带来了巨大困难。如何克服冷冻电镜数据中生物大分子结构的柔性、尤其是超大型复合物的柔性对结构测定精度带来的误差,是当前全球结构生物学研究的重点和难点,也是亟待打破的“瓶颈”。
复旦大学最新开发的智能算法,成功地攻克了以上难题。研究团队推出了一种基于深度学习的计算方法,可有效地识别和处理生物大分子的柔性信息,从而提高冷冻电镜的解析能力,并获取三维结构的动态变化信息。图1与图2展示了两个典型结果。
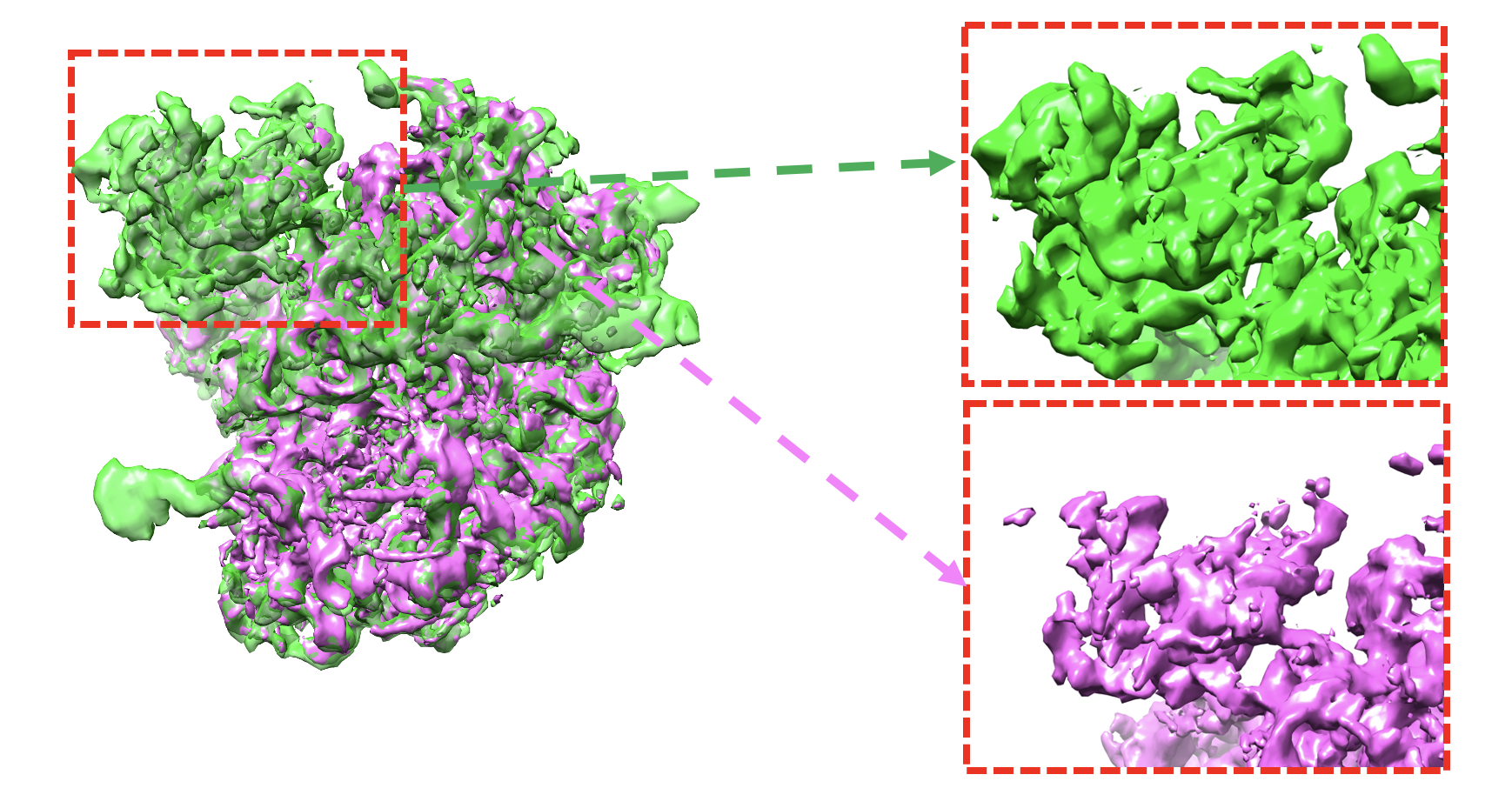
图说:OPUS-DSD重构结构模型与传统冷冻电镜软件解析的模型对比。在虚线标示的区域中,OPUS-DSD重构的模型(绿色)比传统冷冻电镜软件解析的模型(紫红色)有更加完整的电子密度。这是因为OPUS-DSD能分开重构不同三维构象,而不会将其重叠在同一个三维模型中。
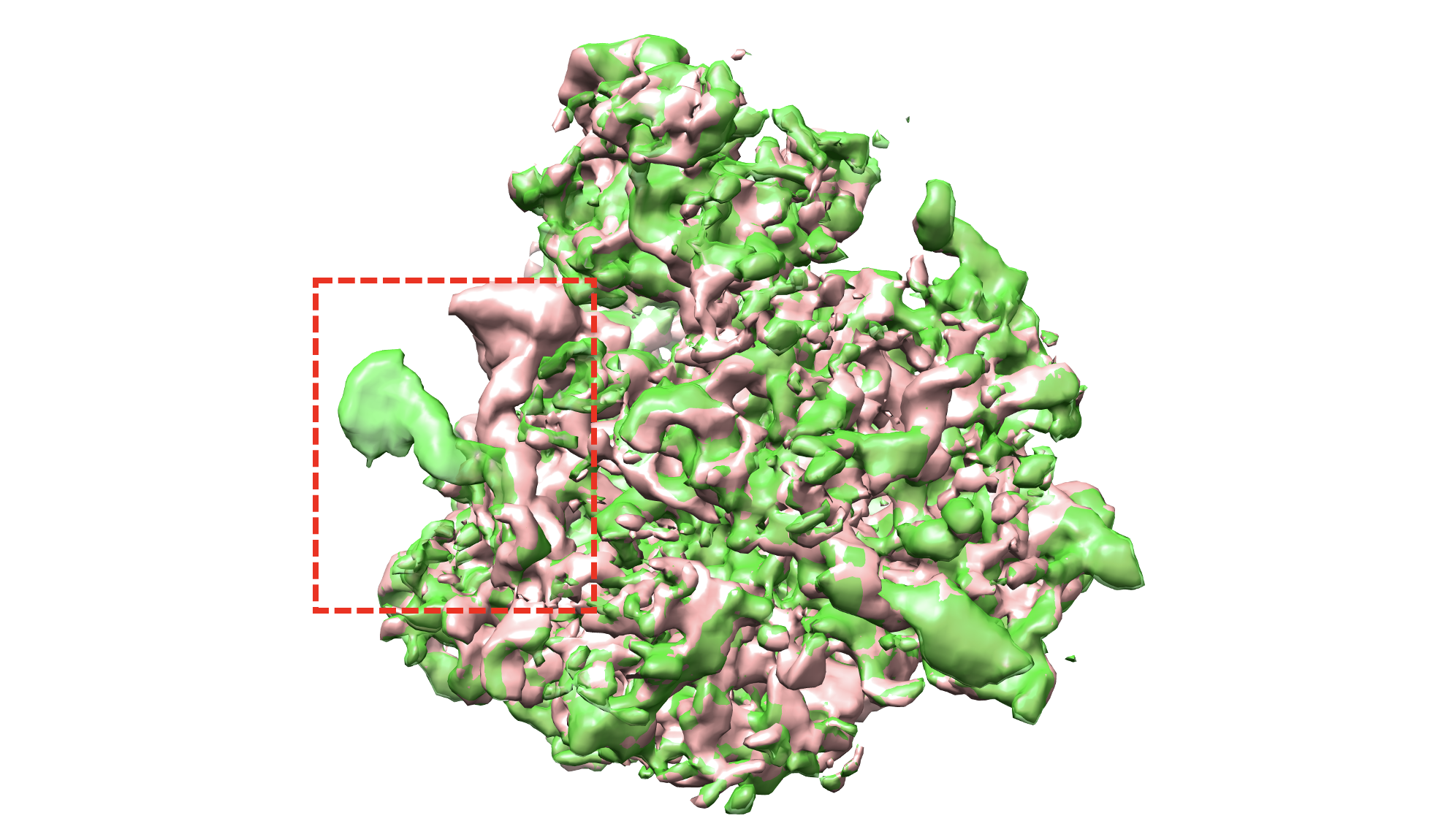
图说:OPUS-DSD解析的构象变化。绿色和古铜色分别代表OPUS-DSD解析的两个不同构象。在红色虚线框标识的区域,不同构象中的RNA链处在不同位置。 这显示了该RNA链处在动态运动中。 这种动态结构信息是很难用传统方法来提取和分辨的。
OPUS-DSD具有卓越的数据处理能力和鲁棒性,能在更低信噪比的数据上保持较高的解析准确性。此外,它不仅仅局限于单颗粒冷冻电镜技术,也可推广到更高端更低信噪比的冷冻断层扫描电镜(Cryo-ET)的研究中。
对于任何运用冷冻电镜解析生物大分子结构的团队,是否具备且会运用先进数据处理算法软件,尤其是针对柔性结构的算法软件,其解析出来的分子结构的质量水平完全不同。复旦团队的这一成果不仅对冷冻电镜生物大分子结构解析技术带来深远的影响,也展示了自主开发国际领先算法软件的实力。在如今计算机硬件设备采购受限的形势下,这个成果展示了“算力不足,算法来补”的重要意义,也为把上海打造成我国科技创新高地竖立了典范。
近年来,AlphaFold等蛋白质结构预测技术的兴起,让计算生物学受到了广泛关注。今年9月21日,AlphaFold的开发者Demis Hassabis 博士和 John Jumper 博士获得了被普遍认为是诺贝尔奖“前奏”的拉斯克奖(The 2023 Lasker Awards)。然而,计算机预测技术还远远不能取代传统的实验结构测定技术,仅可起到补益与增强作用。绝大部分生物大分子的结构,特别是超大型复合物的结构,将继续依赖实验测定来实现。因此,该项针对冷冻电镜数据处理技术的重大突破,对结构生物学的影响意义重大。
作为蛋白质结构预测领域顶尖团队,由诺贝尔奖得主迈克尔·莱维特和马剑鹏领导的复旦大学复杂体系多尺度研究院,聚焦基础科学、交叉学科及源头底层技术,致力于推动生物大分子结构实验测定与计算机预测两大方法齐头并进。团队不仅拥有规模化冷冻电镜平台,更具备一支实力扎实的人工智能人才队伍,在冷冻电镜先进算法和计算机蛋白质结构预测领域科研成果频出。
“优秀算法的研究绝非一日可就,难度极大,耗时漫长,需要研究人员有坐长期冷板凳的勇气,每一个大的进步,往往都需要很多很多年的积累。”马剑鹏表示。他在结构生物学、计算生物学等交叉领域耕耘近40年,由其团队自主研发的OPUS-系列国产软件性能领跑全球。
未来,团队将继续以人工智能为技术中枢,构建新一代生物体系分析工具与方法,解读生物遗传信息,加速生命科学在分子层面的研究。通过对蛋白质、核酸等生物大分子功能结构的预测与设计,为药物研发提供支持,支撑全链条AI-赋能新药研发的先进技术平台。
作者:沈湫莎
图片:受访者供图
责任编辑:任荃
*文汇独家稿件,转载请注明出处。





