又一片新药研发的“处女地”被开垦出来!北京时间4月13日23:00,国际著名学术期刊《自然》杂志在线发表了中国科学院上海药物研究所吴蓓丽研究组、赵强研究组联合上海科技大学水雯箐研究组,在孤儿受体信号转导机制研究方面取得突破性进展。
该研究团队成功解析两种黏附类GPCR(adhesion GPCR)ADGRD1和ADGRF1分别与G蛋白结合的复合物三维结构,并开展了深入的功能相关性研究,首次阐明这类孤儿受体自发激活的分子机制,为研究该类受体的信号转导机理和未来的药物设计提供了重要依据。
G蛋白偶联受体(G protein-coupled receptor, GPCR)与众多疾病密切相关,是最大的药物靶标蛋白家族,超过40%的上市药物通过与这些受体作用发挥其疗效,围绕GPCR的药物研发一直是国际医药产业的竞争高地。
虽然近年来对GPCR的结构与药理学研究不断有突破性成果产生,但至今仍有100余种GPCR的配体和信号转导通路不明,它们被称为“孤儿受体”。这些孤儿受体相关的研究极为匮乏,而它们作为药物开发的“处女地”,是潜在的药物靶标“源泉”,为创新药物研发带来机遇。
作为目前研究最不透彻的GPCR家族,黏附类GPCR的几乎所有成员都是配体未知和功能不明的孤儿受体。它包含33种受体,参与调控免疫反应、器官发育和细胞通讯等生理过程,与精神分裂症、多动症和癌症等多种疾病密切相关。
ADGRD1和ADGRF1作为两种黏附类受体,被发现是多种癌症的致癌基因,但其在分子水平上如何被激活和调控,相关的作用机制仍不清楚。
此次,上海药物所的联合研究团队通过测定ADGRD1和ADGRF1分别与G蛋白结合的复合物结构,发现受体自身的一部分可作为内源性激动剂,使受体激活。
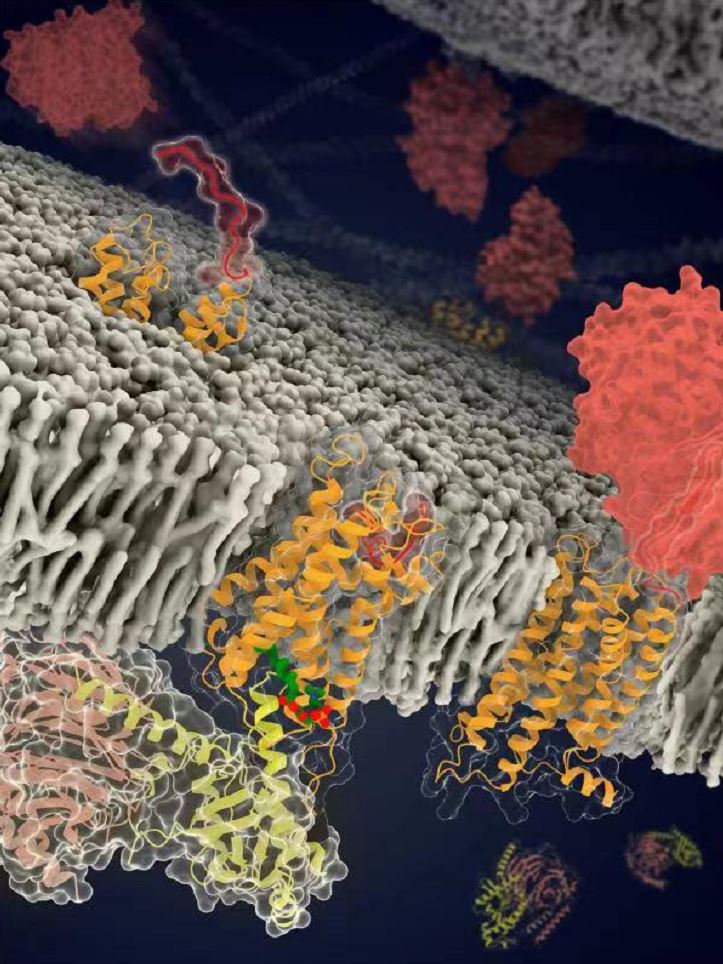
▲黏附类受体结构示意图。黏附类受体在细胞黏附和信号转导中发挥重要作用,是癌症和神经系统疾病等的潜在药物作用靶点。图中处于不同功能状态的ADGRF1结构或模型用橙色飘带图表示,受体中的stalk区域用红色表示,脂分子LPC用绿色表示,GAIN结构域为砖红色,G蛋白的三个亚基分别为黄色,浅粉色和浅灰色。
这个充当激动剂的部分是位于受体胞外结构域和跨膜结构域之间的一段多肽(包含约20个氨基酸),被称为“stalk”。该区段通过与受体跨膜结构域作用,导致跨膜螺旋发生构象变化,从而激活受体,使其与G蛋白结合。这种受体自发激活方式从未在其它类型GPCR中被发现,充分体现了黏附类受体信号转导机制的独特性。
研究团队还对这两个受体的多个结构进行了细致研究,解开了许多结构和功能上的谜团,为未来的药物设计提供了精准的模板,将有助于靶向这两种黏附类受体的癌症治疗药物开发。
此外,该研究还首次发现细胞膜的脂质成分LPC与ADGRF1特异性结合,并对受体功能发挥调控作用,极大地拓展了对于GPCR功能调控机制的认识。
上海科技大学iHuman研究所执行所长、刘志杰教授表示,这些受体的研究极具挑战性,该研究首次在原子水平上揭示了该类受体的自发激活机制,发现了一种从未在其它类型GPCR中发现的自激活模式,其分子机理的揭示为这类受体的功能研究和药物研发提供了重要基础。此外,这项研究极大地拓展了我们对黏附类受体信号转导和功能调控机制的认知,对于后续的功能研究和药物研发将产生重要影响。
中国科学院上海药物研究所吴蓓丽研究员、赵强研究员和上海科技大学水雯箐教授是研究论文的共同通讯作者,第一作者是上海药物所博士生瞿向利、硕士生邱娜和上海科技大学博士生王沐、助理研究员张冰洁。
作者:许琦敏
图片:中科院上海药物所提供
责任编辑:任荃
*文汇独家稿件,转载请注明出处。





