
大多数导致疾病的遗传变异很难有效纠正,且没有过多的副产物。
2019年10月21日,博德研究所David Liu团队在Nature在线发表题为”Search-and-replace genome editing without double-strand breaks or donor DNA“的研究论文,该研究描述了Prime编辑,这是一种通用且精确的基因组编辑方法,它使用融合了工程逆转录酶的催化受损的Cas9,将新的遗传信息直接写入指定的DNA位点,并使用Prime编辑向导RNA(pegRNA)进行编辑。

研究人员在人细胞中进行了175次以上的编辑,包括靶向插入,缺失和所有12种类型的点突变,而无需双链断裂或供体DNA模板。研究人员在人类细胞中应用了Prime编辑功能,以有效地纠正镰状细胞疾病(要求HBB发生转化)和Tay-Sachs病(要求HEXA发生缺失)的主要遗传原因。四个人类细胞系和有丝分裂后的小鼠皮层神经元原代以不同的效率支持Prime编辑。与碱基编辑相比,Prime编辑提供了效率和产品纯度方面的优势;与碱基编辑相比,具有互补的优势和劣势,并且在已知Cas9脱靶位点处的脱靶编辑比Cas9核酸酶低得多。Prime编辑大大扩展了基因组编辑的范围和能力,并且原则上可以纠正约89%的已知致病性人类遗传变异。
在任何活细胞或有机体的基因组中进行任意改变的能力都是生命科学的长期愿望。尽管基因组编辑技术取得了飞速发展,但与疾病相关的已知> 75,000种人类遗传变异中的大多数仍然难以纠正。可编程核酸酶(例如CRISPR-Cas9)产生双链DNA断裂(DSB),可以通过在靶位点诱导插入和缺失(indels)的混合物来破坏基因。
然而,DSB与不期望的结果相关,包括易位和p53激活等。此外,绝大多数病原体等位基因来自特定的插入,缺失或碱基取代,需要更精确的编辑技术来纠正。
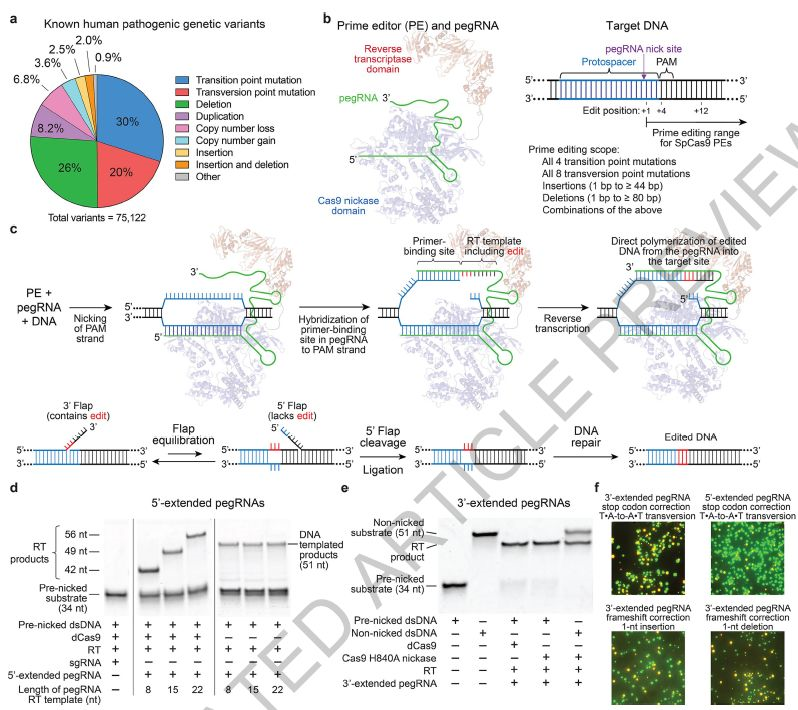
▲体外和酵母细胞中Prime编辑和可行性研究的概述
DSBs刺激的同源性定向修复(HDR)已被广泛用于精确的DNA编辑。但是,HDR依赖于外源供体DNA修复模板,通常会通过DSB的末端修复产生过量的indel,并且在大多数治疗相关的细胞类型(T细胞和某些干细胞是重要的例外)中效率低下。虽然提高DSB介导的编辑的效率和精度仍然是有前途的工作的重点,但这些挑战促使人们探索替代的精确基因组编辑策略。
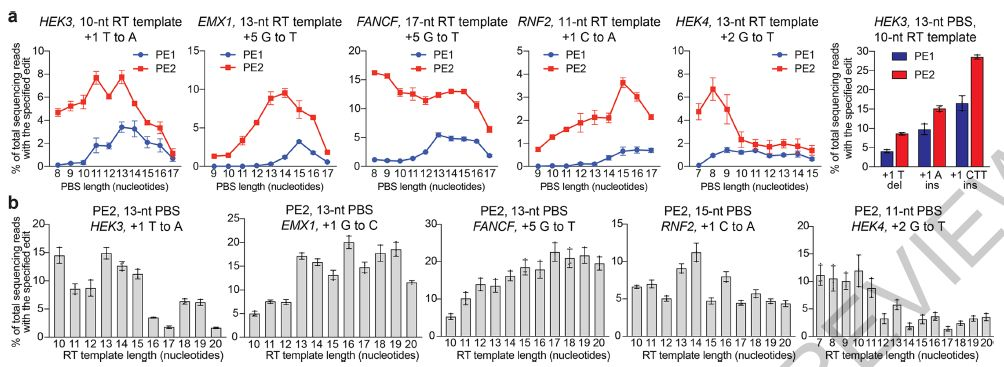
▲PE1和PE2对人类细胞中的基因组DNA进行初步编辑
碱基编辑可以有效地进行四个碱基转换突变(C→T,G→A,A→G和T→C),而无需在包括哺乳动物在内的许多细胞类型和生物体中使用DSB,但目前无法执行八个转换突变 (C→A,C→G,G→C,G→T,A→C,A→T,T→A和T→G),例如需要从T?A到A?T突变直接纠正镰状细胞病(HBB E6V)的最常见原因。 此外,尚无报道采用无DSB的方法进行靶向缺失,如去除引起Tay-Sachs病(HEXA 1278 + TATC)的4碱基重复,或靶向插入,如需要直接插入3个碱基来纠正最常见的囊性纤维化病因(CFTRΔF508)。因此,即使在大多数细胞类型中,有针对性的转化,插入和缺失也很难有效校正,并且没有过多的副产物,即使它们共同构成了大多数已知的致病等位基因。
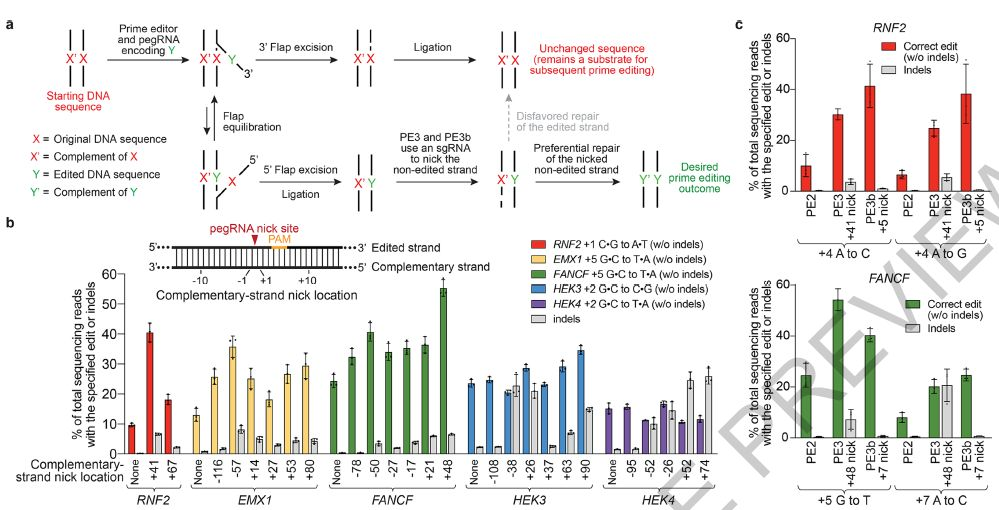
▲PE3和PE3b系统在非编辑链上刻痕以提高Prime编辑效率
在这里,研究人员描述了Prime编辑的发展,一种“搜索并替换”的基因组编辑技术,可在人细胞中介导靶标插入,缺失,所有12种可能的碱基间转换及其组合,而无需DSB或供体DNA模板。最初以PE1为例的Prime编辑器(PE)使用与RNA可编程切口酶融合的逆转录酶(RT)和Prime编辑扩展的指导RNA(pegRNA),将遗传信息从pegRNA的延伸部分直接复制到目标基因组DNA位点中。 PE2使用工程RT来提高编辑效率,而PE3切掉未编辑的链以诱导其替换并进一步提高编辑效率。
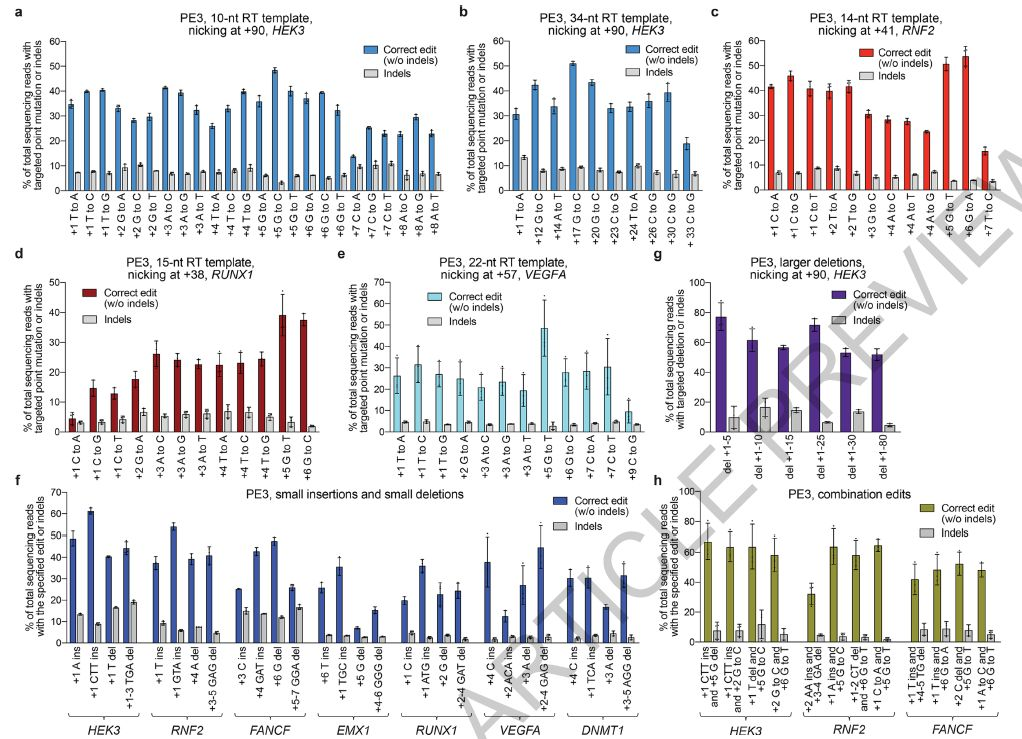
▲在HEK293T细胞中的七个内源基因组位点,用PE3靶向插入,缺失和所有12种类型的点突变
与已知的Cas9脱靶基因座相比,Prime编辑提供的脱靶活性远低于Cas9,与Cas9引起的HDR相比,副产物少得多,效率更高或相似,并且与碱基编辑器相比具有互补的优势和劣势。通过无需DSB或供体DNA模板即可进行精确的靶向插入,缺失和所有12种可能的点突变类别,Prime编辑具有促进绝大多数致病等位基因研究和校正的潜力。
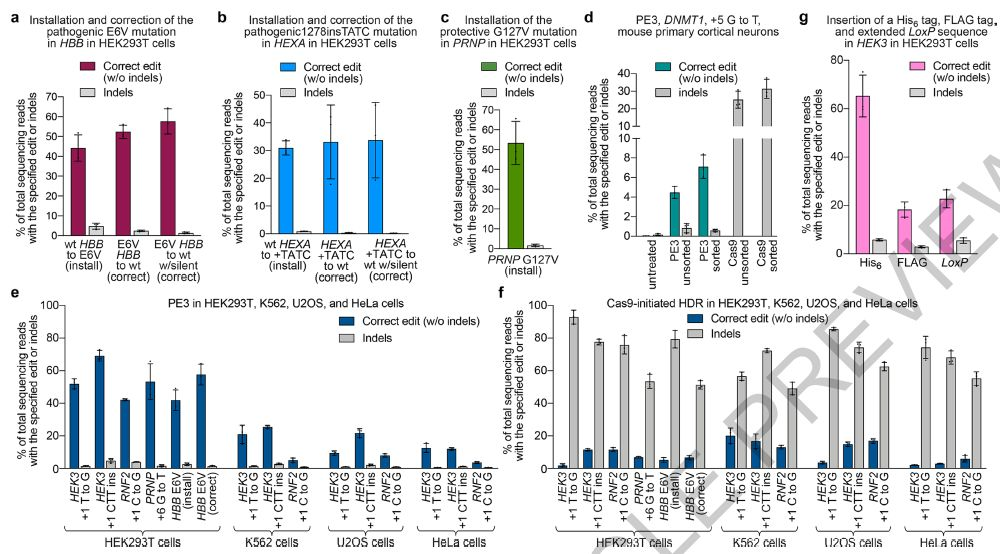
▲Prime编辑致病性突变,对原代小鼠皮层神经元进行Prime编辑,并比较四种人类细胞系中的Prime编辑和HDR
与碱基编辑相比,Prime编辑提供了效率和产品纯度方面的优势;与碱基编辑相比,具有互补的优势和劣势,并且在已知Cas9脱靶位点处的脱靶编辑比Cas9核酸酶低得多。Prime编辑大大扩展了基因组编辑的范围和能力,并且原则上可以纠正约89%的已知致病性人类遗传变异。
作者:枫叶
编辑:储舒婷
责任编辑:姜澎
来源:iNature
声明:转载此文是出于传递更多信息之目的。若有来源标注错误或侵犯了您的合法权益,请作者持权属证明与本网联系,我们将及时更正、删除,谢谢。





