2023年8月2日,中科院上海药物研究所徐华强研究员、段佳研究员和杨德华研究员共同在Nature杂志上发表了最新研究成果,在国际上报道了第一个高分辨率GPCR——神经降压素受体(NTSR1)与GRK2的复合物结构,揭示了GRK2识别和调控GPCR的详细分子机制,并通过结构解析,首次发现了一个全新的GPCR偏向性配体结合口袋,为临床开发靶向GPCR的偏向性药物分子开辟了全新的思路和途径。
该成果揭示了GPCR信号转导领域现存的一个最为关键的科学问题,即GPCRs如何受GRKs识别和调控,这一成果是细胞信号转导教科书级别的原创性成果。中国科学院院士饶子和称其为“GPCR领域又一个里程碑式成果”。
G蛋白偶联受体(GPCRs)是一类广泛存在于人体细胞膜上的膜受体,是细胞信号转导的重要调节分子。GPCRs参与调控人体几乎所有的生命活动过程。人体基因组能编码超过800个GPCRs。目前,FDA批准上市的临床药物中,约三分之一的药物作用于GPCRs发挥治疗作用,GPCRs被认为是新药研发领域中最重要,也是最有应用前景的药物靶点之一。
GPCRs在被配体激活后,主要通过下游的G蛋白或arrestin通路行使特定的生理功能。然而,GPCRs在招募arrestin蛋白之前,必须被GPCR激酶(GRKs)识别和调控,因此GRKs被认为是调控GPCR两条信号通路转换的关键分子。
目前,在整个GPCR信号转导领域存在三个最为关键的科学问题,分别是GPCRs如何识别和招募下游G蛋白、GPCRs如何识别和招募下游arrestin蛋白、GPCRs如何被GRKs识别和调控。
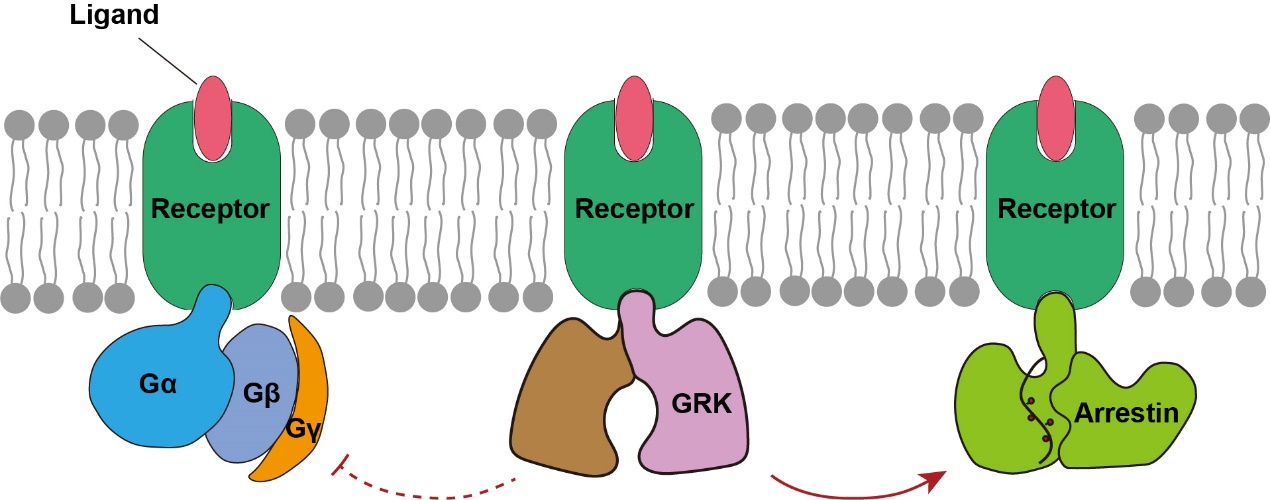
▲GPCRs信号转导领域最关键的三个科学问题
在这项研究中,作者首先通过建立Tango assay平台,用于评估受体与GRK之间的相互作用强弱,继而通过大量筛选,发现NTSR1是与GRK2相互作用最强的受体,因此选择NTSR1作为研究对象。
NTSR1是一种典型的A类GPCRs,其通过内源性神经降压素(NTS)介导神经传递和调节,广泛参与调控人体血压、血糖、体温、镇痛、神经元损伤等。NTSR1主要被GRK2和GRK5识别和调控。据报道,NTSR1是治疗成瘾、肥胖、镇痛、癌症、帕金森病和精神分裂症的一个重要药物靶标。
通过一系列先进的技术手段,作者最终成功解析了第一个高分辨率GPCR与GRK2的复合物结构,揭示了近几十年来GPCRs信号转导领域遗留的最为关键的一个科学问题。
结合细胞水平的突变实验,本研究首次阐明了GRK2识别和调控NTSR1的详细分子机制,考虑到GPCRs结构的相似性和保守性,该机制同样可拓展于其他GPCRs。通过结构解析,本研究也首次揭示了SBI-553作用于NTSR1的受体口袋,并发现了SBI-553通过直接占据G蛋白的结合位置从而实现了arrestin偏向性激动的分子基础。
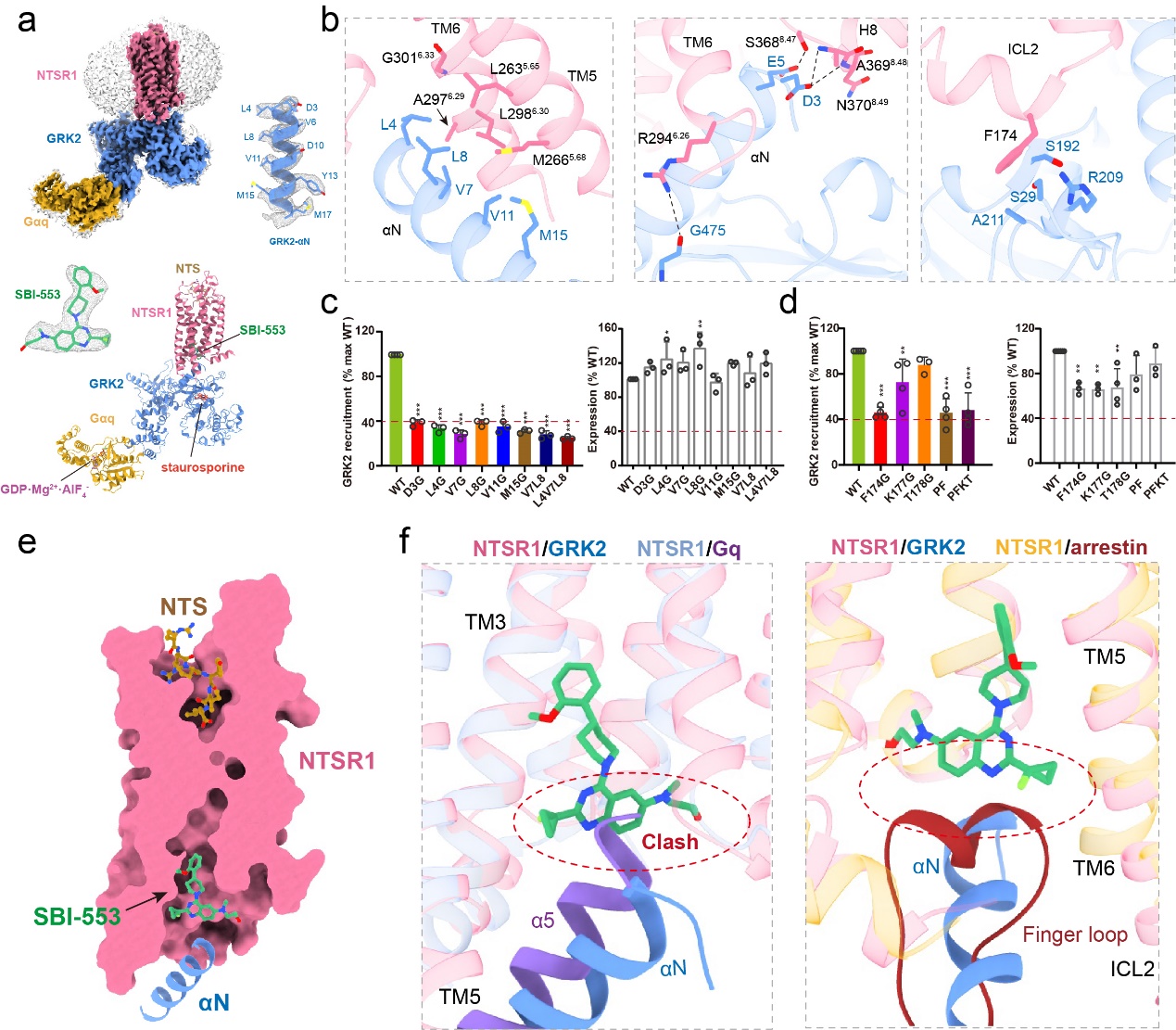
▲NTSR1-GRK2结构特征
徐华强课题组长期专注于生物大分子复合物的结构解析及功能研究,特别是在GPCRs信号转导复合物的研究中积累了大量的经验。本项研究也正是课题组前十年的研究基础上,通过进一步发展NanoBiT交联技术及化学交联等一系列手段和技术,首次成功解析了高分辨率的GPCR-GRK复合物结构,揭示了GPCR信号转导领域现存的一个最为关键的科学问题,即GPCRs如何受GRKs识别和调控,这一成果是细胞信号转导教科书级别的原创性成果。
GPCRs与GRKs的微弱相互作用和高度动态使得传统的X-射线晶体学无法实现结构解析,本项研究中使用的多种技术方法结合单颗粒冷冻电镜技术将为今后研究其他生物多元动态复合物提供重要的启发和指导依据,从而推动整个生物大分子多元动态复合物研究的进程。
令人十分意外的是,本项研究中首次揭示了SBI-553结合于受体胞内侧的疏水口袋中,与此前所报道的所有小分子结合口袋均不同,这为今后开发靶向GPCRs的新型偏向性药物开辟了全新的思路和途径。
本研究也首次阐明了SBI-553实现偏向性激活受体arrestin通路的结构机制。值得一提的是,徐华强课题组7月31号在Nature上报道了B类GPCRs的新型G蛋白偏向性小分子激动剂,揭示了G蛋白偏向性配体的作用机制。结合本项研究,两项研究首次全面系统地揭示了两种不同类型的偏向性激动剂介导受体偏向性信号转导的详细分子机制,极大地促进了我们对GPCRs偏向性信号转导的理解与认识,为今后开发靶向GPCRs的偏向性药物分子提供了夯实的结构基础。
作者:许琦敏
图片:受访者提供
责任编辑:任荃
*文汇独家稿件,转载请注明出处。





