
聚集在肿瘤部位的光敏药物,再配合特殊的光照,两者里应外合,可联手杀死肿瘤细胞。这就是光动力疗法。
近日,中国科学院上海光学精密机械研究所在该领域取得重要进展:利用800纳米的近红外光开展双光子荧光显微成像和活体成像实验,成功抑制了小鼠肺部肿瘤的生长,小鼠的生存期延长了一倍以上。这为深层肿瘤提供了新的诊疗方案,相关成果发表在学术期刊Nanoscale上。
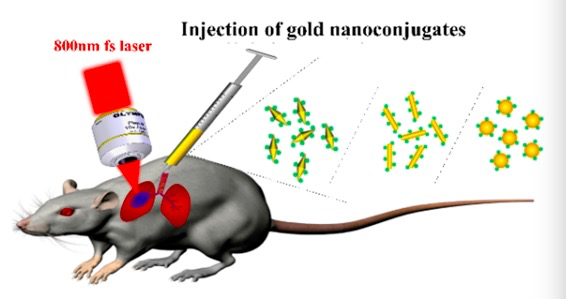
▲研究人员利用800纳米的近红外光开展双光子荧光显微成像和活体成像实验,成功抑制了小鼠肺部肿瘤的生长,小鼠的生存期延长了一倍以上。(中国科学院上海光学精密机械研究所供图)
当特定波长的光照射肿瘤部位时,光敏药物能够被活化,并生成单线态氧、羟基自由基等强氧化性物质进而杀死肿瘤细胞。这一诞生于二十世纪70年代末的光动力疗法在近几年得到迅猛发展。相较于化疗、手术等传统方法,光动力疗法具有无创无损、实时动态、精确治疗、低副作用的优势。不过,什么样的光适合于光动力疗法一直是科研人员们探讨的课题——它必须具备可以穿过人体重重“屏障”、直抵肿瘤细胞的穿透力,同时,它还得有足够的“力气”击中光敏药物。
过去,人们采用波长在400纳米至600纳米之间的可见光作为光源激发,这些可见光能量虽强,但穿透力较差,当这些光穿过人体时,不可避免会被人体吸收或散射,抵达肿瘤细胞时,光的能量已经大幅降低,因此极大抑制了光动力疗法在临床上的应用。如果采用波长为800纳米的近红外光作为光源,虽然它的穿透力更好,可它“天生能量就较弱”。
光的穿透力强弱与其能量的高低是一对矛盾体。为了解开难题,在研究中,上海光机所的研究团队同香港科技大学合作,他们设计了一种新的材料——新型金纳米双锥,它能像“信号兵”一样,同时吸引两个800纳米波长的光子向它“开炮”。“两个800纳米光子的能量足够强,而且在这一波段,光的穿透力也更强。”刘军说,研究人员再把“信号兵”负载到光敏药物中,这就解决了传统光动力治疗穿透能力差、难以抵达病灶的难题。在历时两年的实验中,研究人员通过对小鼠活体肺部深度原位肿瘤的治疗对比实验,充分证实了双光子光动力治疗的效果——经光照治疗后小鼠肺部肿瘤的生长即被明显抑制,小鼠的生存期延长了一倍以上。
据悉,这一研究成果有望促进双光子光动力治疗技术在临床上的应用,未来或可造福病患。
作者:见习记者 金婉霞
编辑:顾军
责任编辑:唐闻佳
*文汇独家稿件,转载请注明出处。





