一种看起来很有希望用于肺癌的表观遗传疗法实际上具有相反的效果,甚至可以增强被认为可以驱动肿瘤的癌症干细胞!
日前,Nature Communications 发表了一项最新研究,波士顿儿童医院的研究人员发现,表观遗传治疗可能会增加肺癌干细胞的发展,同时增加了肿瘤干细胞对癌症发展驱动的证据。
研究人员也基于此提出了癌症治疗的新策略。
表观遗传学是指在基因组序列不变的情况下,基因表达发生了可遗传的变化,并最终导致了表型的变化。这些表观遗传学变化包括DNA的甲基化修饰、组蛋白的各种修饰等。
过去十年来对人类癌症基因组的综合分析显示,在许多癌症中参与基因表达,DNA修复和DNA复制的表观遗传调控蛋白都出现了突变。组蛋白突变可以阻碍细胞分化,促进恶性肿瘤发展。这些发现表明表观遗传调节失控在癌症的发生和进展中起了关键作用。
因此,靶向控制基因开关酶的表观遗传疗法,在癌症治疗领域越来越受到关注。
在这项研究中,研究人员对一种抑制G9a酶(一种组蛋白甲基转移酶)的表观遗传疗法进行研究。近年来的研究表明,组蛋白甲基化转移酶G9a调控自噬反应和细胞分化,在肿瘤发生过程中起着重要作用。
在一般的肿瘤细胞实验中,靶向G9a的抑制药物会减缓癌细胞生长甚至杀死癌细胞,但是研究人员这次却发现,抑制G9a酶的药物却使得存活的肿瘤细胞更像肿瘤干细胞,并进一步促进肿瘤的发展。

肿瘤干细胞是肿瘤的一部分,可以自行再生肿瘤。肿瘤干细胞对肿瘤的存活、增殖、转移及复发有着重要作用。从本质上讲,肿瘤干细胞通过自我更新和无限增殖维持着肿瘤细胞群的生命力。目前已经在血癌和多种实体瘤中鉴定出肿瘤干细胞。
研究论文第一作者Rowbotham表示,“人们研究了肺部肿瘤的细胞系,发现他们对于靶向G9a的抑制药物很敏感,但我们发现这些药物会使得肿瘤细胞更像干细胞,这是我们看到的现象。”
波士顿儿童医院干细胞研究项目的Carla Kim博士及其同事也已经证明,肿瘤干细胞在最常见的肺癌类型腺癌中发挥关键作用。当他们从肺癌小鼠中将肿瘤干细胞移植到正常小鼠体内时,能够导致健康小鼠的癌症发生。
Kim 表示,“早期的研究可能因为肿瘤干细胞难以检测,G9a的这一不利因素并未引起注意。当你用这些药物治疗时,肿瘤干细胞就更多,因为它们只是肿瘤的一小部分,任何影响它们的因素都很容易被遗漏。”
但研究人员同时也发现了一个可能更好的靶标:组蛋白去甲基化酶。与组蛋白甲基化转移酶不同,去甲基化酶的作用是从组蛋白中去除甲基。据此研究人员还确定了一种减少肿瘤干细胞细胞,抑制小鼠肺癌的策略。
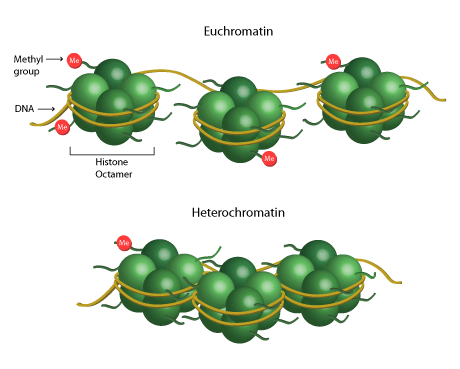
▲组蛋白甲基化
当研究人员给具有确定肺肿瘤的小鼠提供去甲基化酶抑制剂时,癌症进展减慢并且比未治疗的小鼠存活更长时间。
尽管尚未在人类腺癌中发现肿瘤干细胞,但 Kim 认为这一发现值得进一步研究。她指出了一个相关的证据,一项2017年的研究发现,去甲基酶抑制剂可有效杀死患者肿瘤中的化疗耐药细胞。
“即使我们无法确定人类患者的肿瘤干细胞,这项研究工作也表明你可以从小鼠模型中研究肿瘤干细胞,并找出可能具有临床重要性的靶点,”Kim说,“它显示了寻找癌症敏感的正确分子的重要性。在腺癌中,去甲基酶抑制剂比甲基转移酶抑制剂更有用。”
研究人员也因此设想了一种针对肺腺癌的两阶段策略,该策略首先针对肿瘤中的一般癌细胞进行治疗,然后添加专门针对癌症干细胞的第二种治疗。
该团队正在进行进一步的研究,以探索去甲基酶抑制剂作为潜在治疗药物,单独或与其他治疗组合的价值。因为去甲基酶抑制剂具有非常广泛的作用,它们还将寻找抑制剂对下游基因的影响,这可以提供更具体的药物靶标。
编辑:李晨琰
责任编辑:姜澎 顾军
来源:综合自“DeepTech深科技”“Sciencedaily”





